Nature Communications:酒精相关性肝病(ALD)是长期大量饮酒引发的一系列肝脏疾病,涵盖了酒精性脂肪肝、肝炎、肝硬化乃至肝细胞癌等多种病理状态。近年来,全球饮酒水平呈现上升趋势,随之而来的是ALD发病率的不断攀升。遗憾的是,目前对于晚期ALD尚缺乏有效的药物治疗手段,肝移植几乎是唯一的治愈途径。
乙醇主要在肝脏代谢,其代谢过程涉及多个酶的参与。乙醇首先在细胞色素P450家族2亚家族E成员1(CYP2E1)和乙醇脱氢酶(ADH)的催化下转化为乙醛,随后乙醛在醛脱氢酶(ALDH)的作用下进一步转化为乙酸。酰基辅酶A合成酶短链家族成员2(ACSS2)是一种关键的代谢酶,能够催化乙酸生成乙酰辅酶A,参与脂肪酸合成、三羧酸循环及表观遗传修饰等过程。尽管已有研究表明ACSS2在多种生理和病理过程中发挥重要作用,但其在ALD中的具体作用机制尚未完全明确。
2025年7月1日,我校胡文全教授团队和中国科学技术大学段亚君教授团队在国际知名学术期刊Nature Communications上发表了题为“ACSS2 protects against alcohol-induced hepatocyte ferroptosis through regulation of hepcidin expression”的研究论文,使用多组学联合分析,揭示了ACSS2通过代谢-表观遗传修饰途径交叉调节全身铁代谢,从而抵抗酒精诱导的肝细胞铁死亡。本研究首先通过结合临床样本和GEO数据库,发现ALD患者血清乙酸水平显著升高,且ACSS2主要富集于肝实质细胞中。酒精处理可剂量依赖性降低AML12、HepG2细胞和原代肝细胞中ACSS2表达,人类和小鼠ALD样本显示酒精摄入后ACSS2水平降低。利用基因编辑技术构建的ACSS2敲除小鼠模型显示,乙醇喂养后,ACSS2缺失加剧肝损伤、炎症反应。相反,ACSS2过表达减轻酒精诱导的不良反应。

在机制研究方面,本研究通过转录组学和氧化脂质组学分析发现,ACSS2缺失导致全身铁稳态紊乱,主要是HAMP1/2(编码铁调素的基因)水平的下降,从而导致血清和肝脏中铁调素水平降低,铁水平升高,脾脏和十二指肠中铁水平降低。铁调素是一种由肝脏合成和分泌的肽类激素,通过与铁泵蛋白(FPN)结合,介导FPN的泛素化,内化及降解,从而阻断铁输出到循环中,对全身铁稳态起到负性调节作用。此外,表观遗传学实验显示,ACSS2特异性结合CBP形成转录调控复合物,促进HAMP1/2启动子区域组蛋白乙酰化修饰。ACSS2缺失时,CBP和乙酰化组蛋白在HAMP1/2启动子区域的富集度降低,导致HAMP1/2表达下调,揭示了酒精介导的ACSS2水平下降引发铁代谢紊乱的分子机制。
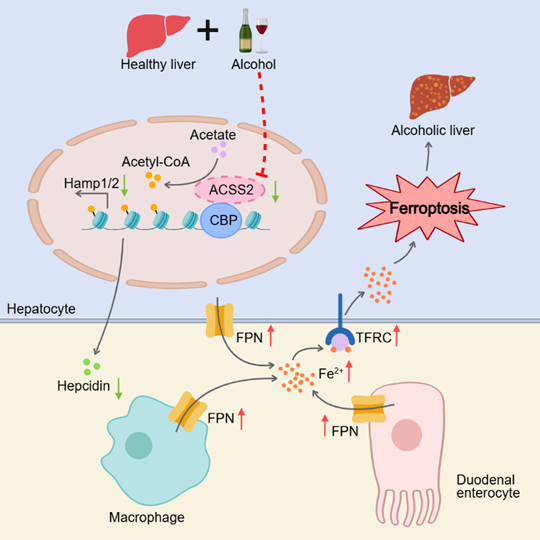
综上所述,本研究揭示了ACSS2在ALD发病机制中的关键作用,即ACSS2通过CBP介导的组蛋白乙酰化调控HAMP1/2表达,从而维持铁稳态并抑制肝细胞铁死亡。这一发现不仅阐明了ALD中铁超载的分子机制,更提出了靶向ACSS2-HAMP轴的治疗新策略。
原文链接:https://pmc.ncbi.nlm.nih.gov/articles/PMC12215787/
Cell Reports:神经母细胞瘤(Neuroblastoma, NB)是最常见的儿童颅外实体肿瘤,起源于交感神经系统,约占儿童癌症相关死亡的15%。该病好发于5岁以下儿童,诊断中位年龄为17个月,其异质性生物学特征导致临床表现差异显著。在诸多遗传学异常中,MYCN基因扩增尤为突出:约20%的NB肿瘤及超40%的晚期肿瘤存在该变异,与不良临床预后及患者生存率低下密切相关。
大量研究表明MYCN缺失可导致肿瘤消退,提示MYCN可能成为治疗NB患者的潜在靶点。然而,由于MYC家族蛋白缺乏小分子特异性结合位点,直接靶向干预一直面临挑战。因此,探索MYCN的上游调控因子,成为目前研究的重点和难点。
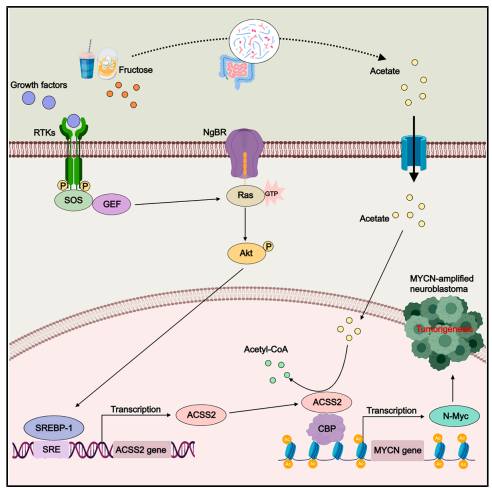
2025年7月3日,我校胡文全教授团队与纽约大学缪清课题组在国际知名学术期刊Cell Reports上发表了题为“High fructose promotes MYCN-amplified neuroblastoma progression through NgBR-ACSS2-mediated biosynthesis of acetyl-CoA”的研究论文,揭示了ACSS2通过调控组蛋白乙酰化修饰抑制MYCN多拷贝的神经母细胞瘤的恶性增殖的分子机制。肿瘤的发生还依赖于细胞代谢的重编程,这一过程会显著影响表观遗传和转录组的调控。

具体而言,短链脂肪酸代谢产物乙酸可作为重要的生物能量燃料,同时也是组蛋白乙酰化底物乙酰辅酶A(acetyl-CoA)的前体。在细胞质和细胞核中负责将乙酸转化为乙酰辅酶A的ACSS2,其抑制已被证实能显著降低多种癌症的肿瘤负荷。此外,大量研究表明ACSS2在众多肿瘤中高表达,且其表达水平通常与不良临床预后及较差的生存率相关。因此,ACSS2可能成为潜在的治疗靶点。然而,ACSS2介导的乙酰辅酶A生物合成对MYCN多拷贝神经母细胞瘤(NB)肿瘤发生的具体作用机制尚不明确,仍需进一步研究。本研究发现ACSS2介导的乙酰辅酶A生物合成及组蛋白乙酰化修饰在促进MYCN多拷贝神经母细胞瘤(NB)生长中的作用。研究发现,人类NB肿瘤中MYCN表达水平的升高与ACSS2表达上调呈正相关。此外,研究还证实膳食乙酸或经肠道微生物群转化为乙酸的果糖补充剂可促进NB异种移植瘤的生长,而这一效应可被ACSS2抑制剂所阻断。我们的研究结果揭示了ACSS2介导的乙酰辅酶A生物合成在调控MYCN多拷贝NB中MYCN表达的新机制,为通过表观遗传学手段抑制致癌性MYCN驱动的肿瘤发生提供了新的治疗视角。
我校胡文全教授,中国科学技术大学第一附属医院/安徽省省立医院心血管内科段亚君教授和纽约大学缪清教授分别为上述论文的通讯作者,中国科学技术大学王梦瑶博士和爱体育「中国」官方网站附属第二医院代谢病研究院文潇博士为论文的第一作者。
原文链接:https://pubmed.ncbi.nlm.nih.gov/40616844/